Z výše uvedených skutečností u našich pacientů používáme polymerní přípravky EV. Účinek enterální výživy je u CN dvojí. Jednak svým imunomodulačním působením na střevní sliznici ovlivňuje aktivitu choroby a jednak zlepšuje nutriční stav pacientů. Kombinace EV a imunosupresivní léčby vychází z filozofie prevence relapsu choroby po ukončení EV na jedné straně a vytvoření časového prostoru (terapeutického mostu) do nástupu účinku imunosupresiva na straně druhé. Na našem pracovišti bývá EV podávána v průměru osm týdnů. Tato doba byla zvolena na základě jednak literárních údajů [4, 9, 10] a jednak znalosti doby nástupu účinku imunosupressiva ( azathioprin, methotrexat).
Někteří pacienti v průběhu podávání EV dospějí operačnímu řešení z důvodu progrese choroby či vzniku konzervativně neovlivnitelné fibrózní stenózy. Většinou jde o pacienty s postižením tlustého střeva nebo terminálního ilea a tlustého střeva. U pacientů s čistým postižením tenkého střeva bývá remise dosaženo téměř ve 100 % případů. U pacientů, kteří dospěli z důvodu progrese choroby k operaci, lze EV považovat za nutriční předoperační přípravu, protože i u těchto nemocných dochází ke zlepšení nutričních parametrů.
Podání antiTNF je spojeno s rizikem vzniku fibrózní stenózy v postiženém úseku střeva. Tato komplikace je pravděpodobně vyvolána nižším inhibičním účinkem antiTNF na produkci růstových a regulačních („fibroplastických“) interleukinů (TGF ß-1, IGF 1, Il 10,11,12]. Výsledkem je potom stimulace proliferace fibroblastů v místě postižení střeva a produkce vaziva. Zdá se, že tuto komplikaci může svým imunomodulačním vlivem na střevní sliznici ovlivnit právě EV. Stenotickou komplikaci s nutností operačního řešení u pacientů s kombinovanou léčbou antiTNF + EV v průběhu jejího podávání jsme doposud nepozorovali.
Druhým obecným důvodem podání EV u CN je ovlivnění nutričního stavu. Je všeobecně známo, že aktivní a zvláště chronicky probíhající CN je spojena s vývojem marantické malnutrice a specifických karencí podle rozsahu a místa postižení gastrointestinálního traktu . Prevalence proteinoenergetické malnutrice u CN je uváděna v rozmezí 60–85 % [12]. Malnutrice je nezávislým rizikovým faktorem průběhu choroby a nežádoucích účinků léčby.
Ze specifických karencí lze uvést popisovaný deficit zinku, pozorovaný často i u našich pacientů. Zinek má zásadní význam pro hojení tkání a jeho deficit může přispívat k perzistenci chronických píštělí. Jakékoliv pozitivní ovlivnění nutričního stavu a úprava deficitů má pozitivní vliv na funkci tělesných systémů včetně imunitního. Mimo jiné je i prevencí nežádoucích účinků léčivých přípravků (kortikoidy, imunosupresiva). Po dvou měsících enterální výživy dochází k signifikantnímu nárůstu BMI, zvýšení hladiny albuminu a cholesterolu a korekci deficitů železa, zinku.
Závěr
Enterální výživa (EV) má u pacientů s CN dvě zásadní indikace:
- U pacientů malnutričních (BMI pod 18,5, pokles albuminu, klinicky významný váhový úbytek) je indikována dlouhodobě. Může být, a nejčastěji je, podávána formou sippingu (popíjením v dávce 300–600 kcal/den), nebo přechodně plnou EV sondou (2000kcal/d) či formou nočního podávání sondou (1000kcal/den) s následným sippingem.
- K ovlivnění aktivity a udržení remise vlastní choroby. U CN snižuje EV riziko relapsu při dávce větší jak 1000–1200kcal/den popíjením nebo sondou. Čím je dávka vyšší tím je riziko relapsu menší. U CN tračníku je efekt malý. K navození remise je doba podávání plné EV(2000kcal/d) minimálně 6–8 týdnů.
Vzhledem k tomu, že EV nemá farmakologické nežádoucí účinky může být podávána dlouhodobě a opakovaně. Toto její využití se týká zejména léčby komplikovaných případů CN, často rezistentních na léčbu a po opakovaných střevních resekcích. Její cyklické použití (2x ročně na 2 měsíce) zlepšuje u těchto pacientů stav výživy a významně snižuje možnost relapsu s rizikem střevní resekce a vzniku syndromu krátkého střeva.
Enterální výživa je alternativou kortikoidní léčby u pacientů s relapsem choroby a riziky léčby steroidy (osteoporóza, malnutrice, dlouhodobá léčba steroidy, děti a adolescenti).
Specifickou skupinu pacientů pak představují nemocní léčeni infliximabem, kde EN slouží jako prevence vzniku ileózních stavů při iniciační léčbě.
Enterální výživa u akutní pankreatitidy
Strategie léčby akutní pankreatitidy se odvíjí od tíže postižení slinivky břišní. Kolem 75 % pacientů má lehkou formu s mortalitou pod 1 %. Zbývající pacienti pak mají formu těžkou s mortalitou blížícím se 20 %. Nutriční podpora je nedílnou součástí komplexní péče zvláště u těžké akutní pankreatitidy. Enterální výživa se v posledním desetiletí stala standardní nutriční a léčebnou modalitou.
Lehká akutní pankreatitida (MAP)
MAP představuje převážnou většinu pacientů s akutní pankreatitidou. Také stran nutriční podpory nacházíme poměrně jasná, klinickými studiemi ověřená, doporučení.
Vlastní nemoc příliš neovlivňuje nutriční stav pacienta, který bývá zatěžován stravou od 3. dne a do 5–7 dní obnovuje plný perorální příjem. Z těchto důvodů není indikována žádná nutriční podpora u standardně probíhající MAP. Pouze při zpoždění startu perorální výživy více než 5 dní je nutriční podpora ke zvážení. Zatím není jasné, zda u vstupně malnutričních pacientů má význam podávání nutriční podpory, která evidentně nepovede k ovlivnění krátce probíhajícího nekomplikovaného onemocnění. Využití EV je tak doménou péče o pacienty s SAP.
Těžké akutní pankreatitida (SAP)
Nutriční podpora u probíhající SAP je esenciální [13]. Důvodem je hypermetabolismus se zvýšením klidového energetického výdeje 1,4–1,5krát. Nacházíme jej u 80 % pacientů se současně probíhající SAP a sepsí. Hyperkatabolismus [14, 15, 16, 17] s negativní dusíkovou bilancí 20g za den zvyšuje mortalitu pacientů [18]. Kritických je přitom zvláště úvodních 5 dní , kdy vlivem stresového metabolismu může dojít až k 60 % snížení funkce dýchacího svalstva a 20% poklesu zásob viscerálního proteinu. Situaci dále zhoršuje téměř 30% přítomnost vstupní podvýživy přijímaných pacientů s SAP [19]. Vzhledem k etiologii SAP se tito často rekrutují z řad alkoholiků, s predispozicí k přítomností podvýživy při příjetí.
Pankreatický klid je zřejmě důležitý faktor v poklesu inflamatorní aktivity, zvláště z hlediska poklesu sekrece pankreatických proteináz. Liší se názory, zda k jeho dosažení je potřeba úplné přerušení podávání výživy do zažívacího traktu, umožněné parenterální výživou [20, 21], nebo je-li dostačující podání enterální výživy do středního resp. distálního jejuna [22, 23]. V současné době nemáme dostatek randomizovaných studií, dávajících jednoznačnou odpověď na tuto otázku. Nicméně jak parenterální, tak enterální výživa podaná za první kličku jejuna, jsou dnes považovány za dostačující k navození pankreatického klidu.
GIT obsahuje 65 % imunitně aktivní tkáně, resp. 80 % tkáně produkující imunoglobuliny. Proto je dnes považováno za „motor“ multiorgánového selhání. Porucha motility, atrofie klků, pokles perfúze s narušením mezibuněčných spojů pak vedou k funkčnímu poškození střeva. Sekundárně dochází k poškození lymfatické tkáně GALT, alterace imunitních procesů (B,T lymfocytů, chemotaxe, fagocytózy, bakteriálního a fugálního zabíjení) a bakteriálnímu přerůstání s translokací, zřejmě odpovědnou za infekci pankreatických nekróz. Převládá názor, že enterální výživa zabraňuje akceleraci těchto změn způsobených hladověním („enteral starvation“) při vyřazení GIT podáváním pouze parenterální výživy.
Parenterální výživa byla dříve považována za jednoznačný standard v nutričním zajištění pacientů s SAP. Její jednoznačně pozitivní efekt však nebyl studiemi nikdy potvrzen. Naopak, z výše popsaných důvodů, se stále více zdůrazňoval význam podávání výživy do střeva od samého počátku onemocnění, nejen k nutričnímu zajištění, ale především ovlivnění dalšího průběhu vlastního onemocnění.
Enterální výživa má dnes srovnatelné, v některých parametrech i lepší, výsledky než parenterální. Jsou to cena a délka hospitalizace, metabolické, septické i celkové komplikace SAP. Dosud však ve studiích nebyl prokázán efekt na snížení mortality pacientů. Známa metaanalýza Marika a Zalogy z roku 2004 poukazuje na redukci septických komplikací, chirurgických intervencí i délky hospitalizace u pacientů s enterální výživou, zjišťuje ale stejnou frekvenci neseptických komplikacích a mortalitu jako u pacientů na parenterální výživě [24]. Otázkou je místo jejího podávání. Již v roce 1970 Vidon prokázal, že výživa podávána do žaludku stimuluje produkci pankreatické šťávy [25]. Konturek již v roce 1972 pak poukazuje na pokles pankreatické sekrece úměrně vzdálenosti stimulace od pyloru [26]. Z toho vychází i dnešní filosofie podání výživy do první kličky jejuna, kde ev. stimulaci považujeme za minimální. EV podáváme nasojejunální sondou zavedenou do první kličky jejuna.
Do této lokality spontánně zaplave při zavádění „naslepo“ 60–75 % sond do 48 hodin. Pokud po této době nemá sonda správnou polohu je na místo určení zavedena endoskopicky. K EV používáme jak polymerní tak oligomerní formule. Použití obou typů přípravků EV je bezpečné. Nutno ovšem uvést, že většina experimentálních prací srovnávající účinek PV a EV používala oligomerní přípravky. Jejich použití splňuje úroveň A doporučení ESPEN [16]. Z našich zkušeností vyplývá bezpečné dlouhodobé použití polymerních přípravků u pacientů, které je tolerují. Prakticky oligomerní přípravky použijeme pouze u pacientů, kteří polymerní přípravky netolerují. Důvodem tohoto postupu je cena, která je u oligomerních přípravků dvou až trojnásobná. Zvláště při dlouhodobém, přechodně domácím podávání enterální výživy do vyhojení pankreatických komplikací, je finanční nákladnost léčby podstatná.
Enterální výživa u SAP má být podána časně, tzn. do 24–72 hodin od přijetí, je-li tolerována. Začínáme nízkou dávkou 10–30 ml/hod a vstupně podávané malé objemy výživy nekalkulujeme do celkové bilance, kterou často zajišťujeme přechodnou parenterální výživou. Po navýšení enterální výživy do cílové dávky, časově obvykle odpovídající odezněním akutní fáze onemocnění, můžeme tuto použít ke kompletnímu nutričnímu zajištění pacienta a parenterální roztoky vysadit.
Enterální výživa u SAP nemá specifické kontraindikace. Při distenzi žaludku lze použít dvouluminální sondy, umožňující živit pacienta do jejuna a současně odsávat stagnující žaludeční obsah.
Doba podávání plné EV u SAP závisí na tíži postižení slinivky, rozsahu nekrózy, lokálních komplikací a celkovém stavu nemocného. Obvykle je plná EV podávání šest týdnů, z toho čtyři týdny v domácích podmínkách. Následuje kontrolní klinické, laboratorní a CT vyšetření. V případě příznivého nálezu jsou pacienti pozvolna zatěžováni stravou (rozjídáni) za monitorace klinického a laboratorního obrazu (ams, crp) . V případě rozvoje komplikací (pseudocysta, trombóza, zánětlivé prosáknutí WOPN) bývá EV prodloužena až na dobu 4 měsíců. Pokud v tomto období dojde k progresi komplikací je většinou indikována chirurgická revize.
Závěr
Akutní pankreatitida a výživa je stále diskutovanou oblastí. Mnohé názory se v letech či desetiletích zcela zásadně změnily, jiné přetrvaly. Tomuto trendu se jistě nevyhneme ani v letech následujících a lze doufat, že nové poznatky povedou ke snížení mortality těžké formy tohoto onemocnění. Zatím ale nezbývá než zopakovat sice obecné, ale stále platné doporučení ESPEN z roku 2006, a to že nutriční podpora je esenciální a enterální výživa je indikována vždy, pokud je to možné (úroveň A, doporučení ESPEN) [16].
Literatura
- O´Morain, C. – Segal, A. W. – Levi, A. J.: Elemental diet as primary treatment of acute Crohn´s disease: a controlled trial. Br Med J 1984; 288: 1859–62.
- Kelly, D.n – Fleming, R.: Nutritional considerations in inflammatory bowel diseases. Gastroenterology Clinics of North America 1995; 24: 597–611.
- Lochs, H. – Steinhardt, H. J. – Kleuas-Weitz, M. et al.: Comparison of enteral nutrition and drug treatment in active Crohn´s disease. Results of the European Cooperative Crohn´s Disease Study IV. Gastroenterology 1991; 101: 881-8.
- Griffiths, A. M.: Inflammatory Bowel Disease. Nutrition 1998; 14:788–91.
- Griffiths, A. M. – Ohlson, A. – Herman, P. et al.: Meta analysis of enteral nutrition as primary therapy of active Crohn´s disease. Gastroenterology 2005; 108: 1056.
- Seidman, E. – Griffiths, A. M. – Jones, A. et al.: Efficacy of a semielemental diet versus prednisone in treatment of acute Crohn´s disease in children. A randomized controlled trial. Gastroenterology 1993; 104: 778.
- Heuschkel, R. – Walker-Smith, J.: Enteral nutrition in inflammatory bowel disease of childhood. JPEN 1999; 23: 29–32.
- Zachos, M. – Tonderu, M. – Griffiths, A. M.: Enteral nutritional therapy for inducing remission of Crohn´s disease. Cochrane Database Syst Rev. 2001; 3: 542.
- Ludvigsson, J. F. – Krantz, M. – Bodin, L. et al.: Elemental versus polymeric enteral nutrition in pediatric Crohn´s disease : a multicentre randomized controlled trial. Acta Pediatr. 2004; 93: 327–335.
- Campos, F. G. – Waitzberg, D. L. – Teixeira, M. G. et al.: Pharmacological nutrition in inflammatory bowel diseases. Nutr Hosp 2003; 18: 57–64.
- Goh, J. – Morain, C. A.: Review article:nutrition and adult inflammatory bowel disease. Aliment Pharmacol Ther 2003; 17: 307–320
- Cabre, E. – Gassul, M. A.: Nutrition in inflammatory bowel disease: impact on disease and therapy. Curr Opin Gastroenterol 2001; 17: 342–9.
- Sobotka, L.: Basics in Clinical Nutrition, Third Edition. Praha: Galén 2004: 339.
- Dickerson, R. N. – Vehe, K. L. – Kuklen, J. L. – Feurer, I. D.: Resting energy expenditure in patients with pancreatitis. Crit Care Med 1991; 19:484–90.
- O´Keefe, S. J. – McClave, S. A.: Feeding the injured pancreas. Gastroenterology 2005; 129:1129–30.
- Meier, R. – Ockenga, J. – Pertkiewicz, M. – Pap, A. – Milinic, N. – Mafie, J. et al.: ESPEN Guidelines on Enteral Nutrition: Pancreas. Clin Nutr 2006; 25:275–84.
- Meier, R. F. – Beglinger, C.: Nutrition in pancreatic diseases. Best Pract Res Clin Gastroenterol 2006; 20:507–29.
- Sitzmann, J. V. – Steinborn, P. A. – Zinner, M. J. – Cameron, J. L.: Total parenteral nutrition and alternate energy substrates in treatment of severe acute pancreatitis. Surg Gynecol Obstet 1989; 1989; 168:311–7.
- Hill, G. L.: Body composition research: Implication for the practise of clinical nutrition. Parentel Enteral Nutr 1992; 16:197–218.
- O´Keefe, S. J. – Lee, R. B. – Anderson, F. P. – Gennings, C. – Abou-Assi, S. – Clore, J. et al.: Physiological effects of enteral and parenteral feeding on pancreatobiliary secretion in humans. Am J Physiol Gastrointest Liver Physiol 2003; 284:G27–36.
- O´Keefe, S. J. – Lee, R. B. – Li, J. – Zhou, W. – Stoll, B. – Dang, Q.: Trypsin and splanchnic protein turnover dutiny feeding and fasting in human subjects. Am J Physiol Gastrointest Liver Physiol 2006; 290:G213–21.
- Vu, M. K. – van der Veek, P. P. – Frölich, M. – Souverijn, J. H. – Biemond, I. – Lamers, C. B. – Masclee, A. A.: Does jejunal feeding activate exocrine pancreatic secretion? Eur J Clin Incest 1999; 29:1053–9.
- Kaustik, N. – Pietraszewski, M. – Holst, J. J. – O´Keefe, S. J.: Enteral feeding without pancreatis stimulation. Pancreas 2005; 31:353–9.
- Marik, P. E. – Zaloga, G. P.: Meta-analysis of parenteral nutrition versus enteral nutrition in patiens with acute pancreatitis. BMJ 2004; 328;1407.
- Vidon, N. – Hecketsweiler, P. – Buttel, J. et al.: Effect of continous jejunal perfusion of elemental and komplex nutritional solutions on pancreatic enzyme secretion in human subjects. Gut 1978; 19:194–8.
- Konturek, S. J. – Tasler, J. – Obtulowicz, W.: Localization of cholecystokinin release in intestine of the dog. Am. J Physiol 1972; 222:19–20.
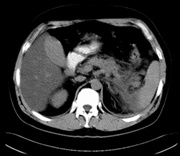
CT obraz těžké akutní pankreatitidy | 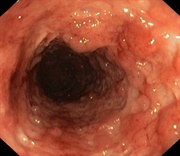
Endoskopický obraz Crohnovy choroby
tlustého střeva |